LE TABLEAU PERIODIQUE DES
ELEMENTS
(actualisé)
Ce tableau est dit périodique car tous les atomes situés
dans une même colonne (de 1 à 18), présentent des propriétés
chimiques proches.
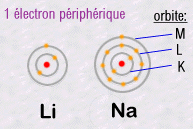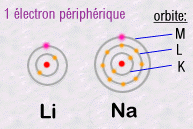
Par exemple, dans la colonne 1, le lithium Li et le sodium Na ont un
comportement chimique proche.
 Pourquoi?
Pourquoi?
Car le nombre d'électrons de leur couche la plus périphérique.est
identique. Li et Na ont un seul électron qui circule sur leur couche
la plus externe: Or c'est cet électron externe qui sera disponible
pour les réactions chimiques avec d'autres atomes. D'où les
mêmes propriétés chimiques et leur regroupement.
Les atomes sont donc groupés en familles:
|
les métaux vrais
|
|
les métaux de transition
|
|
les métalloïdes
|
|
les non-métaux
|
|
les gaz rares
|
|
les lanthanides
|
|
les actinides
|
|
les transuraniens = tous les éléments au-delà
de l'uranium
|
La famille des gaz rares présentent une particularité:
L'hélium, le néon, l'argon etc sont des atomes très
peu réactifs car ils possèdent une couche électronique
externe complète. Cette couche saturée en électrons
est très stable et donc l'atome ne cède ni n'accepte d'autres
électrons. Les liaisons chimiques interatomes sont donc quasi-impossibles
pour les gaz rares.
Cela dévoile une règle d'or de la chimie: Tout
atome tend à compléter sa couche électronique externe
,
cela en captant ou en cédant des électrons à d'autres
atomes.
Plus Z est élevé, plus les noyaux
sont gros et instables: ils ont alors une tendance à se fragmenter
en d'autres atomes plus petits et stables: ce sont des atomes radioactifs.
Dans le tableau périodique, les atomes radioactifs sont:
-
le technétium 43
-
le samarium 62
-
tous les éléments à partir du
polonium dont Z est supérieur ou égal à 84.


 Pourquoi?
Pourquoi?